基本信息
- 中文名称
- 氟维司群
- 英文名称
- Fulvestrant
- 商品名
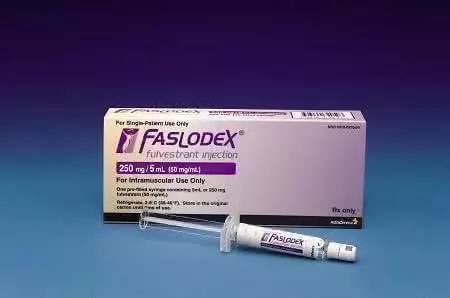
- Faslodex
适应症
本品可用于在抗雌激素辅助治疗后或治疗过程中复发的,或是在抗雌激素治疗中进展的绝经后(包括自然绝经和人工绝经)雌激素受体阳性的局部晚期或转移性乳腺癌。
用法用量
1.成年女性(包括老年妇女):推荐剂量为每月给药一次,一次250mg。尚缺乏更高剂量下中国患者使用的安全有效性信息。
2.儿童及青少年:因尚未确定本品在儿童及青少年中的安全性和有效性,故不推荐在该年龄层中使用本品。肾功能损害的患者:对于轻度至中度肾功能损害的患者(肌酐清除率≥30ml/min),无需调整剂量。未在严重肾功能损害的患者(肌酐清除率<30ml/min)中评价本品的安全性和有效性,因此建议这些患者慎用。
3.肝功能损害的患者:对于轻度至中度肝功能损害的患者无需调整剂量。但由于在这些患者中氟维司群的暴露可能增加,故应慎用本品。没有本品对于重度肝功能损害患者的研究资料。使用方法:臀部缓慢肌注。
警告
1.已知对本品活性成份或任何辅料过敏的患者; 2.孕妇及哺乳期妇女; 3.严重肝功能损害的患者。
不良反应
氟维司群一般耐受性良好,不良反应与阿那曲哇相似,包括胃肠道症状、潮热、骨骼肌肉症状,以及不常见的血栓栓塞。
以下不良反应的发生频率,是基于下述研究中本品250mg治疗组的合并数据计算而 得的:研究9238IL/0020,研究9238IL/0021,研究9238IL/0025,研究D6997C00002 (CONFIRM),研究 D6997C00004 (FINDER 1),研究 D6997C00006 (FINDER 2),及研究 D6997C00003 (NEWEST)*表本品250mg在临床研究中不良反应的总结,基于所得数据,尚缺乏本品与本品临床研究中所报告的偶见或罕见不良事件之间存在 因果关系的证据;
试验9238IL/0020和9238IL/0021:请参考[临床试验]项中详细试验信息;
试验9238IL/0025:研究0025是在从未接受过内分泌治疗的疾病晚期患者或在前12个 1月的辅助治疗中未接受过内分泌治疗的患者中,比较了氟维司群250mg与每天一次口 服20mg的他莫昔芬作为晚期乳腺癌治疗的疗效和安全性,总共587名患者(313名在 |氟维司群组,274名在他莫昔芬组);
试验D6997C00002(CONFIRM):请参考[临床试验]项中的详细试验信息;
试验D6997C00004 (FINDER 1)和D6997C00006 (FINDER 2): FINDER1 和FINDER2 均为II期研究,用于评价三种氟维司群治疗方案(每月一次氟维司群500mg、每月一次氟维司群250mg或每月一次氟维司群250mg +首剂及两周时使用500mg作为负荷 剂量)的疗效、PK和安全性在曰本患者与西方患者之间的潜在种族差异。研究的目 |标人群为先前内分泌治疗(芳香化酶抑制剂或抗雌激素)后乳腺癌进展或复发的激素 1受体阳性的绝经后妇女。每个试验中大约有145名患者;
试验D6997C00003(NEWEST): NEWEST是一项II期试验,用于比较雌激素受体阳 |性患有乳腺癌的绝经后妇女以氟维司群500mg和氟维司群250mg作为新辅助治疗对 1于肿瘤增殖的影响,以及疗效和耐受性。总共211名患者(109名在氟维司群500mg 组,102名在氟维司群250mg组)。
药物相互作用
与咪达唑仑(CYP3A4的底物)相互作用的临床研究表明氟维司群对CYP3A4无抑制作用;
与利福平(CYP3A4的诱导剂)和酮康唑(CYP3A4的抑制剂)相互作用的临床研究 表明,氟维司群的清除率未发生临床相关性的改变。故同时使用氟维司群与CYP3A4抑制剂或诱导剂时无需调整氟维司群给药剂量。
特定人群使用
孕妇禁用本品。在大鼠和家兔中单剂肌注本品后,可见氟维司群透过胎盘。动物试验中显示氟维司群具有生殖毒性,包括胎儿畸形率和死亡率升高。应建议育龄妇女在接受治疗时使用有效方式避孕。如在使用本品期间患者怀孕,应告知对胎儿的潜在危害和流产可能。在哺乳大鼠中可见氟维司群分泌入乳汁。尚不明确氟维司群是否会分泌入人的乳汁,考虑到氟维司群对哺乳期婴儿潜在的严重不良反应,哺乳期间禁用本品。
- 词条统计
-
- 浏览次数: 21964次
- 最近更新: 2018-09-03
- 创建者: Hans